체내에서 직접 만드는 항암제 카티 기술이 256조 시장을 연다
체내에서 직접 만드는 항암제 카티 기술이 256조 시장을 연다
체내에서 직접 만드는 항암제 카티 기술이 256조 시장을 연다
손님 취급에서 벗어나라 외국인 체류자에게 진정한 통합 필요
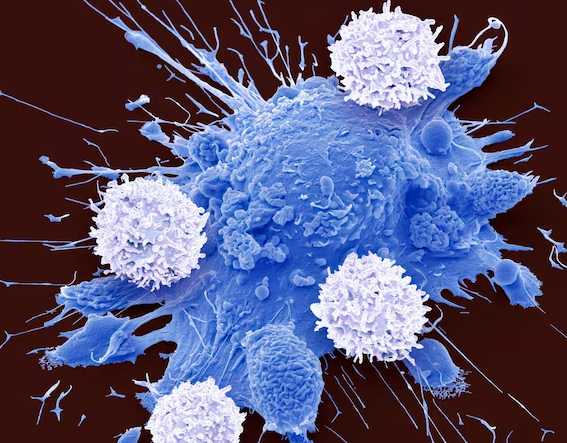
한 번 체내에 주입되면 지속적으로 증식하며 암세포를 파괴한다는 이유로 ‘살아있는 약물’ 또는 ‘암세포의 연쇄살인마’로 불리는 치료제가 있다.
그것이 바로 카티(CAR-T) 세포 치료제다. CAR은 키메라 항원 수용체(Chimeric Antigen Receptor)의 약자로
그리스 신화 속 여러 동물의 특징을 가진 키메라처럼, 면역세포인 T세포에 암세포 표면의 항원 단백질을 탐지할 수 있는 유전자를 결합한 것이다.
기존 항암제와 달리 정상 조직은 해치지 않고 암세포만 선택적으로 공격하기 때문에 치료 효과가 뛰어나다.
카티 세포 치료제는 특히 기존에 치료제가 없던 혈액암에서 혁신적인 결과를 보여주었다.
2017년 스위스 노바티스의 킴리아(Kymriah) 이후, 2022년 영국 오토러스 테라퓨틱스의 오캣질(Aucatzyl)까지 포함해 총 7종의 치료제가 미 식품의약국(FDA) 승인을 받았다.
글로벌 시장 조사기관 폴라리스 마켓 리서치&컨설팅에 따르면, 카티 치료제 시장 규모는 2022년에 약 10조 원
2023년에는 15조 원을 초과하며, 2034년에는 약 256조 원에 달할 것으로 전망된다.
그러나 가장 큰 문제는 비용이다. 환자의 T세포를 추출한 뒤 유전자를 추가하고 이를 다시 환자 몸에 주입하기까지 많은 시간과 비용이 소요된다.
현재 한 번 치료에 약 50만 달러(약 6억 8천만 원)의 비용이 들 정도다.
이에 따라, 국제 학술지 네이처는 과학자들이 이 비용을 획기적으로 줄일 방법을 개발 중이라고 지난달 보도했다.
새로운 접근법은 환자 체내에서 T세포를 암 치료에 최적화된 형태로 직접 변형하는 방식이다.
이 방법이 상용화될 경우, 환자가 더 쉽게 치료를 받을 수 있으며 시장 규모 또한 확대될 전망이다.
이는 살아있는 항암제의 대중화 시대를 앞당기는 데 기여할 것이다.
기존의 체외(ex vivo) 방식으로 카티 세포를 제조하는 데는 몇 주가 걸린다.
먼저 환자의 체내에서 T세포를 추출한 뒤, 암세포를 탐지할 수 있는 유전자를 전달해야 한다.
이를 위해 항암 유전자를 담은 바이러스를 T세포에 주입하면, T세포 표면에 암세포를 찾아 공격하는 수용체가 생성된다.
이후 유전자가 변형된 T세포를 증식시킨 다음 다시 환자의 몸속에 투입한다.
이때 변형된 T세포는 암세포를 지속적으로 탐지하고 제거하며, 탐지 능력 또한 유전자에 각인되어 지속된다.
최근 과학자들은 이 모든 과정을 체내(in vivo)에서 구현하고 있다.
원리는 기존의 체외 방식과 비슷하지만, 체내 방식의 핵심은 암세포와 결합하는 유전자를 정확히 T세포에만 전달하는 것이다.
기존 체외 방식은 T세포만 추출해 작업하기 때문에 다른 세포가 영향을 받지 않지만, 체내에서 실시하면 암 유전자가 잘못된 세포에 전달될 위험이 있다.
이를 방지하기 위해 각 연구팀은 다양한 방법론을 개발 중이다.
미국 필라델피아주 인터리우스 바이오테라퓨틱스는 T세포와 NK(자연살해) 세포 표면 단백질만을 표적으로 하는 바이러스 벡터(유전자 전달체)를 연구하고 있다.
그와 동시에 워싱턴주의 우모자 바이오파마는 T세포 표면의 세 가지 단백질 모두에 결합할 수 있는 바이러스 벡터를 개발하여 실험 중이다.
이 방식은 단일 단백질과 결합하는 기존의 방법보다 동물실험 단계에서 훨씬 높은 정확도를 보여주었다고 보고되었다.
체외 방식의 카티 세포 제조는 전용 시설에서만 가능하며, 환자는 해당 시설에 수주간 머물러야 한다.




